Você já deve ter ouvido falar de Cinética no ramo da Física, mas hoje não iremos para esse lado. Cinética Química é o tema que iremos discorrer e, pode acreditar, sua definição é simples! Ela é, basicamente, a velocidade das reações químicas. Isso se dá entre os reagentes e seus produtos. Durante o consumo e sua formação há uma velocidade.
A + B C + D
Reagentes Produtos
Essas reações são o conjunto de duas ou mais substâncias que reagem entre si, gerando, enfim, um resultado final. O cálculo está inteiramente baseado no fator consumo e formação, entre reagentes e produtos. Este estudo é importante para ampliar os domínios e conhecimentos na indústria, mas também faz parte do nosso dia a dia.
Classificação das reações de acordo com a cinética química

Há 3 categorias para expressar o tempo gasto durante essas reações: rápidas – ou mesmo instantâneas – moderadas e lentas. É bom estar ciente de quanto tempo se leva para ter essa reação, para que, na medida do possível, possa interferir ao nosso favor, nas produções. Imagine o quanto podemos ajudar para retardar a degradação ambiental.
Com a noção de tempo das reações, podemos interferir em processos como: acelerar a decomposição de resíduos como o lixo que geramos em nossas casas. Parece simples, mas estaríamos salvando a vida do planeta, graças a Cinética Química.
Rápidas, ou instantâneas
Pensamos, por exemplo, em uma explosão, ou quando acendemos o fogo no fogão, ou seja, a queima do gás de cozinha. Todos os casos citados possuem uma reação instantânea, são microssegundos envolvidos na ação.
Lentas
Neste caso, temos um tempo mais estendido, demorado, como a formação do petróleo. São anos e anos, até mesmo séculos, de decomposição orgânica para chegarmos ao produto final usado na produção de tantas coisas. Não foi fácil chegar ao batom que você usa, ou ao combustível queimado no seu carro, por isso, chamamos essa fonte de não renovável, porque leva eras de reações para se formar.
Moderada
Essas levam tempo, mas não tanto quanto o petróleo, talvez horas, ou minutos. A vela que queima e derrete, o alimento apodrecido pela ação de bactérias, um papel queimando todos são exemplos que, com certeza, você já viu acontecer e se encaixa nessa categoria.
Concentração de reagentes

A concentração na Cinética Química é fator decisivo no que diz respeito a velocidade. O choque molecular desencadeia um processo de quebra que resulta em novas formações e, portanto, a multiplicação dessa ação depende da concentração do reagente. Vejamos:
Superfície de contato
Aqui levamos em consideração as superfícies sólidas. O contato será mais exposto e a velocidade da reação é muito maior. Já passou mal e teve que tomar um sal de frutas para ajudar na digestão? Então, nesse caso de superfície de contato, a reação de um Sonrisal é extremamente ligeira quando a colocamos em contato com a água.
Pressão
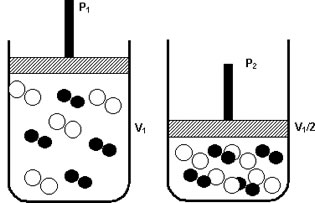
Sabe aquele feijãozinho cozido na hora? Ele está incluído nesse caso. A pressão aqui acelera o processo, as moléculas diminuem os espaço entre si aumentando a velocidade do cozimento, isto é, a reação. Esse comportamento pode, então, fazer com que haja uma redução do volume, devido ao afastamento das moléculas. Portando, não se esqueça, quanto maior for a pressão, maior será a velocidade da reação.
Temperatura

A energia cinética aqui é fundamental, pois a temperatura elevada aumenta a agitação das partículas e, consequentemente, estimula a velocidade da reação. Provavelmente, você que é cozinheiro, sabe bem do que se trata. Para atingirmos uma meta de horário e terminar logo o cozimento de uma determinada comida, aumentamos o fogo, ou, em contraste, diminuímos para ganhar mais tempo.
Catalisadores
Os catalisadores são capazes de aumentar a velocidade das reações químicas sem alterar o seu equilíbrio, ou seja, a composição permanece a mesma. Este método é usado com frequência nas indústrias, mas há um caso, que já passamos, que também ocorre dentro deste processo. Quando colocamos água oxigenada no machucado aparecem bolhas. Isso acontece, porque o sangue é um catalisador biológico, possui enzimas e elas reagem em pequenas quantidades.
Por fim, leia também sobre Biotecnologia, o que é, história e como influencia no seu dia a dia
Fonte: Brasil escola, Educação uol, Descomplica, Só química. Info Escola, Brasil Escola, Só Química, Mundo e Educação, Manual da Química.
Imagem de destaque: Todo estudo



