Já viu um metal mudar de cor? Então, isso é oxidação!
O termo sempre foi usado para denominar as reações que tinham como reagente o oxigênio. No entanto, posteriormente descobriram que, algumas vezes, o processo ocorria sem esse elemento. Mesmo assim, à essa altura, o termo já tinha sido implementado, e o nome foi mantido.
Hoje iremos conhecer mais sobre as reações de oxidação, como ocorre e os principais exemplos.
O que é oxidação?
Oxidação é a perda de elétrons por um átomo, grupo, ou espécie iônica, em meio a uma reação química.
Além disso, oxidação pode ser chamada de “oxirredução” (redox), já que as suas reações ocorrem simultaneamente com a transferência de elétrons.
Como ocorre a reação de oxidação?
Desse modo, a oxidação ocorre quando há um aumento do NOX (número de oxidação) do átomo quando comparado ao reagente e ao produto.
Portanto, esse processo pode acontecer em três casos:
- Quando há uma adição de oxigênio à substância em questão.
- Quando a substância perde hidrogênio.
- Quando a substância perde elétrons.
Oxidação na Química Orgânica
Portanto, o processo de oxidação pode ocorrer com hidrocarbonetos, principalmente os alcenos. Desse modo, na química orgânica, esse processo acontece de quatro formas: combustão, ozonólise, oxidação branda e oxidação energética.
Confira a seguir o que são cada uma delas:
Combustão
Combustão é toda reação química que se dá na presença de um combustível e do comburente gás oxigênio (O2). E que, por fim, resulta na produção de calor e luz. Nesse caso, o oxigênio tem como principal função oxidar o combustível. Ou seja, isso faz deste gás o agente oxidante da combustão.

No entanto, a combustão pode ser completa ou incompleta. Assim sendo:
- Combustão Completa: ocorre quando há abastecimento suficiente de oxigênio. Ao final da reação, formam-se dióxido de carbono (CO2) e água (H2O).
Exemplo:
Combustão Completa do metano: CH4 + 2O2 → CO2 + 2H2O
- Combustão Incompleta: não há oxigênio suficiente, formam-se monóxido de carbono (CO) e água (H2O).
Exemplo:
Combustão incompleta do butano com produção de monóxido de carbono: 2C4H10 + 9O2 → 8CO + 10H2O
Ozonólise
Na ozonólise, o agente oxidante, que rompe a ligação do alceno, é o ozônio (O3). Dessa forma, quando a dupla ligação se quebra, os carbonos passam a se ligar com os oxigênios do ozônio, o que resulta no ozoneto, que é instável e explosivo. Contudo, o ozoneto reage com água na presença de um agente redutor, como o zinco, por exemplo; e assim, resulta em aldeídos e cetonas.
Sendo assim, observe o exemplo abaixo:

Oxidação Branda
A oxidação branda acontece quando o agente oxidante é um composto como o permanganato de potássio (KMnO4), presente em solução aquosa, diluída e resfriada, neutra ou ligeiramente básica.
No caso desse processo, a identificação ocorre através do Teste de Baeyer, usado para diferenciar alcenos de ciclanos isômeros. Sendo assim, veja o exemplo abaixo:

Oxidação Energética
Ao contrário da oxidação branda, nesse processo, a solução de permanganato de potássio está inserida em um meio ácido e quente. Sendo assim, a sua decomposição, que originará o oxigênio atômico, será um processo mais energético.
Nesse sentido, a oxidação do alceno, também é mais energética, isso porque as duas ligações da ligação dupla são rompidas e os átomos de oxigênio se ligam ao carbono. Desse modo, podem gerar esses produtos:
- Se o carbono da dupla for terciário:o produto será uma cetona;
- Se o carbono da dupla for secundário: o produto será um ácido carboxílico;
- Se o carbono da dupla for primário: o produto será o ácido carbônico, que se decompõe em dióxido de carbono (CO2) e água (H2O).
Desse modo, veja como acontece nos exemplos abaixo:

Exercícios de Oxidação
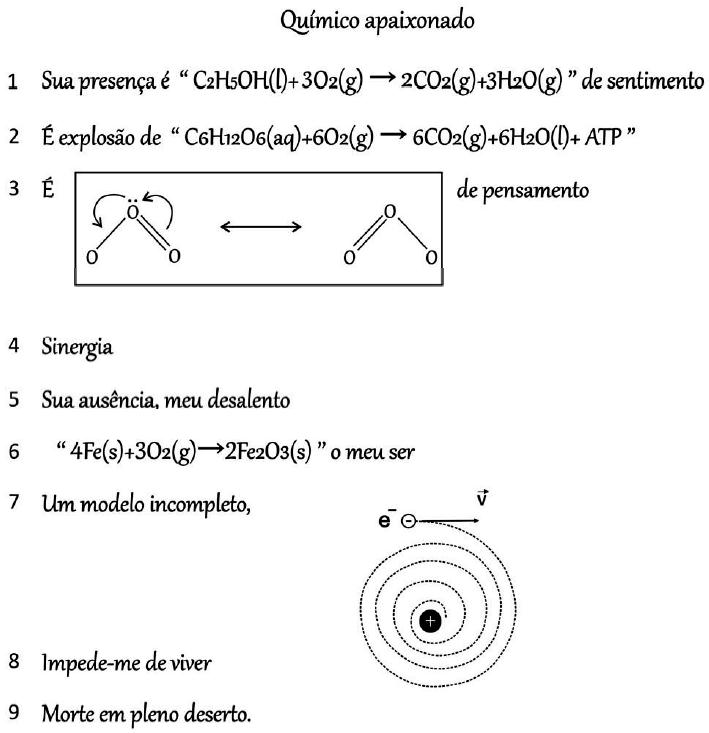
Questão 1. (Fuvest 2021)
No fragmento a seguir, o autor explora conceitos químicos na forma de poesia:
Sobre os conceitos mencionados, foram feitas as seguintes afirmações:
I. A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de fotossíntese com consumo de gás carbônico.
II. A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada à corrosão.
III. O modelo incompleto referido na linha 7 refere-se ao proposto por Thomson, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Está correto o que se afirma no(s) item(ns):
a) I, apenas.
b) II, apenas.
c) I e III, apenas.
d) II e III, apenas.
e) I, II e III.
Resposta: Letra B). A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de respiração celular e produz gás carbônico.
Assim, a equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies sofre alteração, sendo associada à corrosão. É a equação que representa o processo de produção da ferrugem (oxidação do ferro).
Logo, o modelo incompleto referido na linha 7 refere-se ao proposto por Bohr, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Questão 2. (Unesp 2021)
As bacteriorrizas são exemplos de associações simbióticas entre bactérias e raízes de plantas leguminosas. Essas bactérias fixam o nitrogênio atmosférico (N2), transformando-o em amônia (NH3). Nessa transformação, o número de oxidação do elemento nitrogênio é alterado de:
a) +2 para –3, sendo reduzido.
b) +2 para +1, sendo reduzido.
c) 0 para +3, sendo oxidado.
d) 0 para +1, sendo oxidado.
e) 0 para –3, sendo reduzido.
Fontes: Brasil Escola, Toda Matéria, InfoEscola